INTRODUCCIÓN
El cultivo de Capsicum annuum, conocido comúnmente como pimiento, es una de las especies hortícolas de mayor importancia a nivel mundial, destacándose en la industria alimentaria, farmacéutica y cosmética debido a sus propiedades nutricionales y medicinales. Las semillas de pimiento son el punto de partida de su producción agrícola, y su calidad es un determinante para el éxito del cultivo, ya que influye directamente en el rendimiento y la eficiencia de las prácticas agrícolas.
Importancia de la Calidad Fisiológica de las Semillas
En términos generales, una semilla de alta calidad es aquella que, bajo condiciones favorables, tiene una alta probabilidad de germinar y desarrollar una plántula sana (Gough, 2020). Las semillas de pimiento, como cualquier otra semilla, poseen un período de latencia que debe ser superado para que inicie el proceso de germinación. Este proceso es influenciado por factores internos de la semilla, como el contenido de agua, la integridad de los tejidos y la actividad metabólica, y factores externos como las condiciones ambientales y los tratamientos pre-siembra (Longo et al., 2020).
La tasa de germinación es uno de los indicadores más utilizados para evaluar la calidad fisiológica de las semillas. Una alta tasa de germinación implica que un porcentaje significativo de las semillas en un lote será capaz de producir plántulas, lo que es esencial para garantizar una siembra eficiente (Taylor, 2020). Sin embargo, por sí sola no es suficiente para medir la calidad de las semillas. Es necesario considerar también la uniformidad de la germinación, que se refiere a cuán simultáneamente germinan las semillas, lo que asegura que las plántulas crezcan de manera homogénea, reduciendo la competencia entre ellas por recursos como agua y nutrientes. La energía germinativa, que mide la rapidez con la que las semillas comienzan a germinar, y el índice de vigor, que evalúa la fortaleza de las plántulas en términos de su desarrollo inicial, son otros dos parámetros fundamentales para caracterizar la calidad fisiológica de las semillas (Sundareswaran et al., 2023).
Además de la germinación, la calidad fisiológica de las semillas tiene un impacto directo en la salud, crecimiento y resistencia de las plántulas una vez germinadas. Semillas de baja calidad pueden originar plántulas débiles, más susceptibles a enfermedades y menos adaptadas a condiciones de estrés ambiental, como la sequía o las temperaturas extremas (Costa, et al., 2021). En un entorno agrícola donde la eficiencia y la productividad son esenciales, el uso de semillas de alta calidad se convierte en un factor determinante para minimizar pérdidas durante las etapas tempranas de crecimiento. Esto es particularmente relevante para los productores que buscan maximizar el rendimiento de sus cultivos y reducir el uso de insumos, como fertilizantes y tratamientos fitosanitarios, que pueden incrementar los costos de producción.
Factores que Afectan la Calidad de las Semillas
La calidad de las semillas de Capsicum annuum está influenciada por factores genéticos, ambientales y de manejo. A nivel genético, las semillas deben provenir de plantas madre con buen rendimiento agrícola para garantizar vigor en la descendencia. No obstante, incluso con un material genético de alta calidad, la viabilidad y vigor pueden verse afectados por el almacenamiento y las condiciones previas a la siembra (Gough, 2020).
Entre los factores externos, el tratamiento pre-siembra, el cual incluye técnicas como el remojo de las semillas, la escarificación o el uso de fitorreguladores y microorganismos beneficiosos han demostrado mejorar la germinación y el vigor (Panda & Mondal, 2020). Estos tratamientos actúan sobre los mecanismos fisiológicos de la semilla, estimulando la actividad metabólica y acelerando el proceso de germinación (Cardarelli, et al., 2022). Por ejemplo, el remojo de las semillas en soluciones específicas, como las que contienen fitorreguladores o microorganismos eficientes autóctonos, puede modificar la estructura celular de la semilla, mejorando su capacidad de absorción de agua y estimulando la activación de enzimas clave para la germinación (Thakur et al., 2022).
Además, las condiciones ambientales como la temperatura, la humedad y la luz son esenciales para activar los procesos bioquímicos que conducen a la germinación (Farooq et al., 2022). El pimiento es particularmente sensible a cambios en la temperatura, y un exceso o defecto de humedad puede inducir la descomposición de la semilla o inhibir su crecimiento (Yang et al., 2024).
Finalmente, los patógenos y enfermedades también afectan negativamente la calidad de las semillas, ya que pueden comprometer la viabilidad de estas antes y después de la germinación. En este contexto, los EMA’s (Microorganismos Eficientes Autóctonos), pueden ser beneficiosos en la protección de las semillas, mejorando la calidad fisiológica al reducir la incidencia de enfermedades (Wang et al., 2022).
Fitorreguladores y EMA’s en la Calidad y Germinación de las Semillas
Los fitorreguladores son compuestos orgánicos, ya sean naturales o sintéticos, que regulan los procesos fisiológicos en las plantas. Estas sustancias son esenciales para el control del crecimiento, la división celular, la elongación y la diferenciación de las células. Existen diferentes tipos de fitorreguladores, entre los que se destacan las auxinas, las giberelinas, las citoquininas y el ácido abscísico, cada uno con un papel específico en los procesos de desarrollo vegetal (Vaishnav & Chowdhury, 2023).
En particular, las giberelinas, son esenciales para la ruptura de la latencia en las semillas y para la activación de las enzimas responsables de la descomposición del almidón y otros nutrientes almacenados en la semilla (Tombegavanie et al., 2020). Estas hormonas pueden estimular la elongación del embrión, facilitando así una germinación más rápida y uniforme (Castro-Camba et al. , 2022). Mientras que las citoquininas promueven la división celular, contribuyendo al desarrollo temprano de las plántulas (Aremu et al., 2020). Además, pueden influir en otros procesos fisiológicos importantes durante la germinación, como la absorción de agua y la activación de las reservas de energía dentro de la semilla (Vaishnav & Chowdhury, 2023).
Diversos estudios han demostrado que la aplicación de fitorreguladores antes de la siembra tiene efectos positivos en la germinación de semillas de pimiento, mejorando tanto la tasa de germinación como el índice de vigor de las plántulas (Cano-González et al., 2021; Samarah et al., 2020). Estos efectos son particularmente importantes cuando las semillas son sometidas a condiciones subóptimas de temperatura y humedad, ya que los fitorreguladores pueden ayudar a mitigar los efectos del estrés. Por ejemplo, en condiciones de sequía o temperaturas fluctuantes, el uso de fitorreguladores permite que las semillas germinen con mayor rapidez y resistencia, aumentando la probabilidad de éxito en la producción del cultivo (EL Sabagh et al., 2022).
Por su parte, los EMA’s (microorganismos naturales, principalmente bacterias y hongos), actúan sobre el suelo, las raíces de las plantas y las semillas, mejorando la nutrición, la protección contra patógenos y la tolerancia al estrés (Balogun et al., 2016). Estos microorganismos han ganado popularidad en los últimos años como una alternativa ecológica y sostenible para optimizar la calidad de las semillas y promover el crecimiento saludable de las plantas. Su principal beneficio es la reducción de la incidencia de patógenos que afectan la germinación y el desarrollo de las plántulas. Muchos de los EMA’s poseen propiedades antibióticas y antifúngicas que inhiben el crecimiento de patógenos en las semillas, lo que favorece una mayor tasa de germinación y una reducción de las enfermedades en las plántulas. Además, algunos microorganismos compiten directamente con los patógenos por los nichos ecológicos en las semillas y raíces, impidiendo que estos se establezcan (Sawicka et al., 2022).
A su vez, los EMA’s mejoran la disponibilidad de nutrientes esenciales para las semillas y plántulas. Algunos microorganismos son capaces de fijar nitrógeno, mejorando la nutrición vegetal (Ramos Cabrera et al., 2024), mientras que otros, como los hongos micorrízicos, forman simbiosis con las raíces, facilitando la absorción de minerales y agua del suelo (Navarro & Morte, 2024). Estos beneficios nutricionales contribuyen al vigor de las semillas y plántulas, incrementando su capacidad para enfrentar condiciones adversas durante el crecimiento temprano. Los EMA’s también tienen un impacto positivo en la resistencia al estrés, ayudando a las plantas a adaptarse mejor a situaciones como sequías, temperaturas extremas o salinidad. Esto se logra mediante la acumulación de compuestos protectores, como antioxidantes, y la regulación de la respuesta hormonal de la planta, lo que mejora su tolerancia al estrés (Armada et al., 2018).
La interacción entre estos tratamientos y sus efectos sobre la calidad de las semillas ha sido objeto de varios estudios, pero aún existen lagunas en el conocimiento respecto a cómo el tiempo de exposición a estos tratamientos y las dosis específicas de fitorreguladores y EMA’s afectan el desarrollo temprano de las plántulas de pimiento. En este contexto, surge la necesidad de explorar y cuantificar los efectos combinados de los fitorreguladores y los EMA’s, así como el impacto de los tiempos de remojo, en la calidad fisiológica de las semillas de pimiento.
Este estudio, por tanto, tiene como objetivo evaluar el efecto de fitorreguladores y microorganismos eficientes sobre la calidad fisiológica de semillas de pimiento (Capsicum annuum). Específicamente, busca determinar el efecto de diferentes dosis de fitorreguladores (giberelinas y citoquininas) y microorganismos eficientes en la calidad fisiológica de las semillas de pimiento (Capsicum annuum), considerando dos tiempos de remojo para determinar sus efectos sobre la germinación y emergencia.
Este enfoque permitirá generar conocimientos aplicables para la mejora de las prácticas agrícolas en la producción de pimiento, contribuyendo a un sistema agrícola más productivo.
METODOLOGÍA
Ubicación y Duración
El experimento se llevó a cabo en dos fases: 1) Fase de laboratorio: realizada en el Instituto Superior Tecnológico Tsa’chila, Santo Domingo-Ecuador, ubicado en las coordenadas geográficas 00°16'88'' latitud sur y 79°12'45'' longitud oeste, a una altitud de 625 msnm, 2) Fase de campo: desarrollada en la Coop. 9 de Diciembre, Santo Domingo-Ecuador, localizada en las coordenadas 0°14'29.5404'' latitud sur y 79°09'33.2064'' longitud oeste, con una altitud de 496 msnm. Estas ubicaciones proporcionaron un entorno adecuado para la investigación, permitiendo la implementación de los tratamientos bajo condiciones representativas de la zona.
Diseño
El experimento se desarrolló mediante un diseño completamente aleatorizado con un arreglo factorial 2 × 4, que incluyó dos tiempos de remojo y cuatro dosis de fitorreguladores (Tabla 1). En total, se evaluaron 8 tratamientos con tres réplicas cada uno, sumando 24 unidades experimentales, cada una conformada por 4 semillas
Tabla 1: Tratamientos según Tiempos de Remojo y Tipo de Fitorregulador
|
Factor A: Tiempo de Remojo |
Factor B: Dosis de Fitorreguladores |
Tratamientos |
|
2 horas (a1) |
2,5 cc de citoquinina L⁻¹ de agua (b1) |
T1: a1 + b1 |
|
2,5 cc de citoquinina L⁻¹ de agua + 5.0 cc de EMA’s L⁻¹ de agua (b2) |
T2: a1 + b2 |
|
|
5,0 cc de giberelina L⁻¹ de agua (b3) |
T3: a1 + b3 |
|
|
5,0 cc de giberelina L⁻¹ de agua + 5,0 cc de EMA’s L⁻¹ de agua (b4) |
T4: a1 + b4 |
|
|
4 horas (a2) |
2,5 cc de citoquinina L⁻¹ de agua (b1) |
T5: a2 + b1 |
|
2,5 cc de citoquinina L⁻¹ de agua + 5,0 cc de EMA’s L⁻¹ de agua (b2) |
T6: a2 + b2 |
|
|
5,0 cc de giberelina L⁻¹ de agua (b3) |
T7: a2 + b3 |
|
|
5,0 cc de giberelina L⁻¹ de agua + 5,0 cc de EMA’s L⁻¹ de agua (b4) |
T8: a2 + b4 |
Variables de Estudio
Las variables dependientes de este estudio están relacionadas con el desempeño de las semillas de Capsicum annuum durante su proceso de germinación y emergencia. Estas variables se centraron en medir la eficiencia y rapidez del desarrollo inicial de las semillas bajo los diferentes tratamientos aplicados. En cuanto a las variables independientes, estas abarcaron los factores manipulados experimentalmente, es decir, los tratamientos aplicados a las semillas (Tabla 2).
Tabla 2. Variables de Estudio y sus Indicadores de Medición
|
Variables |
Indicadores |
Unidad de Medida |
|
Dependiente |
Índice de velocidad y germinación (IVG) |
Conteo |
|
Porcentaje de germinación (PG) |
% |
|
|
Índice de velocidad de emergencia (IVE) |
Conteo |
|
|
Porcentaje de emergencia (PEM) |
% |
|
|
Independiente |
Dosis de fitorreguladores |
cc |
|
Tiempos de remojo |
Minutos |
Manejo del Ensayo
El ensayo se llevó a cabo bajo condiciones controladas de laboratorio para evaluar la calidad fisiológica de las semillas de Capsicum annuum tratadas con diferentes fitorreguladores y microorganismos eficientes autóctonos. Las semillas de Capsicum annuum fueron seleccionadas para asegurar su uniformidad en tamaño y calidad. Se llevaron a cabo pre-tratamientos para eliminar cualquier posible contaminación antes de aplicar los tratamientos experimentales. Las semillas fueron sumergidas en soluciones que contenían diferentes dosis de fitorreguladores (citoquinina y giberelina) y/o microorganismos eficientes autóctonos durante dos tiempos de remojo: 2 horas y 4 horas.
Métodos de Evaluación
Para la prueba de germinación, se utilizó el método “entre papel” de la International Seed Testing Association (ISTA, 2017). Las semillas se colocaron sobre toallas de papel humedecidas, enrolladas y mantenidas en una cámara de germinación a 30 °C durante 7 días. Se realizaron conteos diarios de las semillas germinadas, definiendo como germinadas aquellas con radícula visible.
El cálculo del IVG se efectuó utilizando la fórmula de Maguire (1962), la cual consiste en sumar los valores obtenidos dividiendo el número de semillas germinadas por los días correspondientes en cada conteo. De esta manera, el IVG refleja la rapidez con la que ocurren las germinaciones a lo largo del tiempo:
![]()
El porcentaje de germinación se determinó considerando el número de semillas germinadas normales en relación con el total de semillas sembradas.
![]()
Al finalizar la prueba, se clasificaron las plántulas en normales (intactas, con defectos leves o con infección secundaria) y anormales (dañadas, deformes, desequilibradas o descompuestas). Asimismo, las semillas sin germinar se categorizaron como duras, frescas o muertas, siguiendo las especificaciones de ISTA (2017).
Para la respuesta de emergencia y vigor, se siguió la metodología de Martínez et al (2010). La prueba de emergencia se realizó en bandejas germinadoras rellenadas con abono EcoAbonaza estéril. Las semillas fueron sembradas a 1 cm de profundidad y sometidas a riegos homogéneos durante 15 días. Se llevaron a cabo conteos diarios de plántulas emergidas, considerando como primer día aquel en que se observó la primera plántula. El índice de velocidad de emergencia (IVE) se calculó mediante la fórmula de Maguire (1962):
![]()
El porcentaje de emergencia (PEM) se obtuvo al finalizar la prueba, considerando el número total de semillas que lograron emerger.
![]()
Análisis Estadístico
Los datos obtenidos fueron sometidos a un análisis estadístico utilizando el software SPSS versión 25.0. Para evaluar las diferencias significativas entre los tratamientos, se aplicó un análisis de varianza (ANOVA de dos factores con interacciones), para determinar si las variaciones observadas fueron debidas al tiempo de remojo, a las dosis de fitorreguladores, o a la interacción entre ambos factores. Se asumió un nivel de significancia de p < 0.05. Cuando el ANOVA reveló diferencias significativas, se aplicó la prueba de Tukey para realizar comparaciones múltiples entre tratamientos e identificar cuáles diferían significativamente en términos de la variable dependiente. Se verificaron los supuestos de normalidad mediante la prueba de Shapiro-Wilk, y la homogeneidad de varianzas utilizando el test de Levene.
RESULTADOS
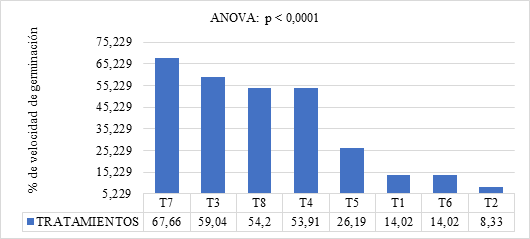
El Gráfico 1 presenta los resultados del índice de velocidad de germinación. Se observa variaciones significativas entre los tratamientos (p < 0.0001), con algunos mostrando una mayor rapidez en la germinación en comparación con otros. Los tratamientos T7 (5 cc de giberelina L⁻¹ de agua durante 4 horas) y T3 (5 cc de giberelina L⁻¹ de agua durante 2 horas) presentaron los valores más altos de IVG: 67,66 y 59,04% respectivamente, superando a las combinaciones que incluyeron citoquininas o EMA’s. Esto evidencia que las giberelinas por sí solas tienen un efecto positivo sobre la precocidad germinativa de las semillas.
Grafico. 1. IVG en Semillas de Pimiento (Capsicum annuum) bajo Condiciones de Laboratorio
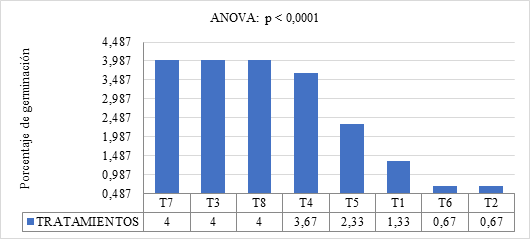
El Gráfico 2 muestra que los tratamientos aplicados generaron diferencias significativas (p < 0.0001) en el comportamiento de germinación de semillas de Capsicum annuum. Los tratamientos que emplearon giberelinas destacaron por su alto porcentaje de germinación. En particular, los tratamientos T7 (5 cc de giberelina L⁻¹ de agua con remojo de 4 horas), T3 (5 cc de giberelina L⁻¹ de agua con remojo de 2 horas) y T8 (5 cc de giberelina L⁻¹ de agua + 5 cc EMA’s L⁻¹ de agua con remojo de 4 horas) lograron valores (4%) superiores a los tratamientos con citoquininas, tanto solas como en combinación con EMA’s. Esto refleja una mayor efectividad de las giberelinas para potenciar la capacidad germinativa de las semillas.
Gráfico 2. Porcentaje de Germinación en Semillas de Capsicum annuum
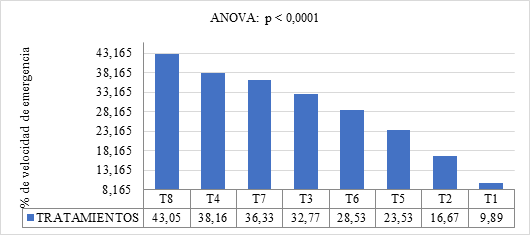
El Gráfico 3 muestra los resultados obtenidos para el índice de velocidad de germinación de las semillas de Capsicum annuum. Se observa diferencias significativas entre los tratamientos aplicados (p < 0.0001). El Tratamiento T8 (5 cc de giberelina L⁻¹ de agua + 5 cc EMA’s L⁻¹ de agua con remojo de 4 horas), fue el más efectivo en la promoción de la emergencia de las semillas, con un valor de 43.05%. Seguido por T4 que incluye 2 horas de remojo con la misma combinación de giberelina y EMA’S. Los tratamientos con giberelina sin EMA’s también mostraron resultados positivos, aunque menores. Esto sugiere que la giberelina es efectiva por sí sola, pero su rendimiento mejora cuando se complementa con EMA’s. particularmente con un tiempo de remojo más prolongado.
Gráfico 3. IVE de Capsicum annuum con Fitorreguladores y Microorganismos Eficientes"
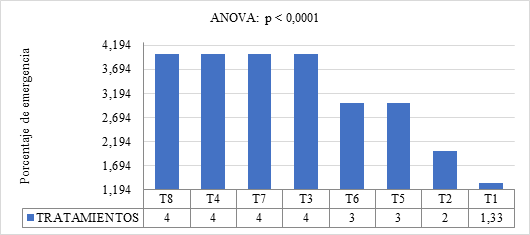
El Gráfico 4 muestra el porcentaje de emergencia de Capsicum annuum. Los resultados indican diferencias significativas entre los tratamientos (p < 0.0001). El Tratamiento T8 (5 cc de giberelina L⁻¹ de agua + 5 cc de EMA’s L⁻¹ de agua durante 4 horas), T4 (5 cc de giberelina L⁻¹ de agua + 5 cc de EMA’s L⁻¹ de agua durante 2 horas), T7 (5 cc de giberelina L⁻¹ de agua durante 4 horas) y T3 (5 cc de giberelina L⁻¹ de agua durante 2 horas), todos con un PEM de 4%, se destacaron como los más efectivos para promover la emergencia de las semillas. Esto sugiere que tanto la combinación de giberelina como de citoquinina con EMA’s tiene un impacto positivo en la emergencia de las semillas, con la giberelina mostrando una eficacia similar cuando se aplica sola durante 4 y 2 horas, mientras que, en ausencia de EMA’s, la citoquinina mostró una menor efectividad.
Gráfico 4. Efecto de Fitorreguladores y EMA’s sobre el PEM en Capsicum annuum
DISCUSIÓN
Los resultados obtenidos muestran que las giberelinas, aplicadas tanto durante 4 horas como durante 2 horas, promovieron la velocidad de germinación en las semillas de Capsicum annuum. Este hallazgo coincide con investigaciones previas que destacan la influencia de las giberelinas en la estimulación del metabolismo enzimático necesario para la movilización de reservas energéticas almacenadas en las semillas, como carbohidratos y proteínas (Guzmán-Ortiz et al., 2019; Hassan et al., 2021). La mayor efectividad observada en T7 (5 cc de giberelina L⁻¹ de agua durante 4 horas) podría estar relacionada con un tiempo de imbibición suficiente para maximizar la absorción de la hormona y activar procesos fisiológicos sin llegar a niveles que pudieran causar estrés o toxicidad. Esto sugiere que tanto la dosis como el tiempo de exposición son factores críticos para optimizar el efecto de las giberelinas en este cultivo. Por el contrario, los tratamientos que incluyeron citoquininas o EMA’s mostraron menores tasas de velocidad germinativa. Este comportamiento ya ha sido reportado por El-Maarouf-Bouteau, (2022), quienes argumentan que, aunque las citoquininas también promueven la división celular, su acción primaria está más relacionada con etapas posteriores al inicio de la germinación, como el crecimiento y desarrollo de plántulas. Esto podría explicar su efecto más limitado en la velocidad de germinación inicial. Asimismo, los EMA’s pudieron haber requerido un período más prolongado para establecer interacciones beneficiosas con las semillas, limitando su impacto en los primeros estadios del proceso germinativo.
De manera similar, las giberelinas, aplicadas tanto de forma individual como en combinación con EMA’s, fueron los tratamientos más efectivos para promover la germinación en Capsicum annuum. En particular, los tratamientos T7, T3 y T8 mostraron porcentajes de germinación significativamente superiores, lo que reafirma el papel protagónico de las giberelinas en el proceso germinativo, incluso bajo diferentes tiempos de remojo. Estos resultados coinciden con los reportados por Bhatla y Lal (2023), quienes atribuyen a las giberelinas su capacidad para romper la dormancia de las semillas al estimular la síntesis de enzimas hidrolíticas, como la α-amilasa, necesarias para la movilización de reservas energéticas, y al promover la expansión celular en el embrión. En contraste, los tratamientos que incluyeron citoquininas, independientemente del tiempo de remojo, presentaron porcentajes de germinación notablemente inferiores. Esto refuerza la idea de que las citoquininas tienen un rol más específico en la división celular y la diferenciación de tejidos, procesos que son esenciales en etapas posteriores al inicio de la germinación, pero menos relevantes para la activación metabólica inicial.
Además, el desempeño ligeramente inferior del tratamiento T4, que incluyó EMA’s y un tiempo de remojo de 2 horas, en comparación con el tratamiento T8, que también incluyó EMA’s, pero con un tiempo de remojo de 4 horas, podría atribuirse a la menor exposición de las semillas al tratamiento hormonal, lo que posiblemente limitó la absorción de los reguladores. Esto sugiere que un tiempo de remojo más prolongado favoreció la acción combinada de las giberelinas y los EMA’s, permitiendo una mayor disponibilidad de compuestos bioactivos en el interior de la semilla y potenciando su efecto en los procesos fisiológicos iniciales. Rafique et al. (2021) respaldan esta hipótesis, destacando que la interacción entre giberelinas y microorganismos depende significativamente de las condiciones específicas de aplicación, incluido el tiempo de cebado.
Por otro lado, los tratamientos que combinaron giberelina y EMA’s demostraron ser los más efectivos para optimizar la velocidad de emergencia de las semillas de Capsicum annuum, en particular cuando se aplicaron con un tiempo de remojo de 4 horas. Este hallazgo sugiere que un mayor tiempo de exposición favorece la acción sinérgica de los reguladores hormonales y los microorganismos, optimizando la emergencia. En línea con estos resultados, estudios como los de Santos et al. (2020) indican que la velocidad de emergencia de las semillas se ve beneficiada por el tiempo de exposición, ya que una mayor duración permite una absorción más eficiente de los compuestos activos y una activación más rápida de los mecanismos de germinación.
En contraste, los tratamientos que solo incluyeron giberelina, aunque mostraron una mejora en la emergencia de las semillas, no alcanzaron la velocidad de emergencia al mismo nivel que los tratamientos con EMA’s. Esto indica que, si bien las giberelinas son eficaces para inducir la emergencia por sí solas, su efecto es potenciado cuando se combinan con los microorganismos, especialmente cuando el tiempo de remojo se extiende.
Finalmente, los tratamientos que combinan giberelina y EMA’s, tanto con 2 como con 4 horas de remojo, demostraron ser los más eficaces para promover la emergencia de las semillas de Capsicum annuum. Esta combinación parece tener un impacto positivo en la capacidad de las semillas para atravesar el sustrato, lo que indica que tanto la giberelina como los EMA’s desempeñan roles complementarios en este proceso. La giberelina, como regulador hormonal, podría estar favoreciendo la elongación y crecimiento de la plántula (Bagale et al., 2022), mientras que los EMA’s probablemente optimizan los mecanismos biológicos de las semillas, mejorando su capacidad para emerger exitosamente del sustrato (Cardarelli et al., 2022). En este contexto, los tratamientos que combinan giberelina y EMA’s resultaron ser más efectivos que aquellos que emplean solo giberelina. Este fenómeno sugiere que la presencia de los microorganismos eficientes tiene un efecto modulador sobre la acción de la giberelina, mejorando su capacidad para inducir la emergencia de las semillas.
CONCLUSIÓN
En conclusión, los resultados obtenidos refuerzan la importancia de los reguladores hormonales, especialmente las giberelinas, y su interacción con los microorganismos eficientes en la mejora de la calidad fisiológica de las semillas de Capsicum annuum. La combinación de ambos elementos, junto con un tiempo de remojo adecuado, no solo optimiza la germinación y emergencia de las semillas, sino que también subraya la relevancia de la sinergia entre estos factores en el proceso de activación fisiológica de las semillas. Este estudio sugiere que la optimización de estos tratamientos, con un énfasis en la duración del remojo de 4 horas, puede ofrecer una herramienta valiosa para mejorar el rendimiento y la consistencia de la germinación en condiciones agrícolas.
Implicaciones y Limitaciones
Los resultados de este estudio proporcionan información valiosa para mejorar los procesos de germinación y emergencia de semillas de Capsicum annuum permitiendo a los productores optimizar sus métodos de cultivo y reducir tiempos de producción. Además, el estudio contribuye al entendimiento de cómo las interacciones entre reguladores hormonales y microorganismos, junto con el tiempo adecuado de exposición, pueden ser aprovechadas para mejorar la eficiencia de los procesos de propagación de semillas en condiciones controladas.
Una limitación importante del estudio es que los experimentos se realizaron bajo condiciones controladas en laboratorio, lo que podría no replicar completamente las variaciones de tiempo y condiciones ambientales presentes en el campo. Los tiempos de remojo evaluados (2 y 4 horas) fueron limitados, y otros intervalos de exposición podrían haber generado resultados diferentes. Además, la respuesta de las semillas puede depender de factores adicionales, como la temperatura y la humedad, que no se variaron en el estudio, lo que podría haber influido en los resultados. También es necesario investigar cómo el tiempo de remojo interactúa con otros factores del ambiente, como la calidad del sustrato y la luz, para obtener una imagen más completa de las mejores prácticas para la propagación de semillas.
Contribuciones
Martínez-Sotelo: Diseño de la investigación, administración del proyecto, análisis e interpretación formal de datos, redacción manuscrito y revisión final del manuscrito. Toma de datos, revisión de la bibliografía y redacción manuscrito. Todos los autores hemos leído y aprobado la versión final del manuscrito, así mismo estamos de acuerdo con la responsabilidad de todos los aspectos del trabajo presentado.
Conflicto de interés
La autora declara que no tienen conflictos de interés en relación con el trabajo presentado.
Uso de inteligencia artificial
No se usaron tecnologías de IA o asistidas por IA para el desarrollo de este trabajo.
REFERENCIAS BibliogrÁFICAS
Aremu, A. O., Fawole, O. A., Makunga, N. P., Masondo, N. A., Moyo, M., Buthelezi, N. M., ... & Doležal, K. (2020). Applications of cytokinins in horticultural fruit crops: Trends and future prospects. Biomolecules, 10(9), 1222. https://doi.org/10.3390/biom10091222
Armada, E., Leite, M. F., Medina, A., Azcon, R., & Kuramae, E. E. (2018). Native bacteria promote plant growth under drought stress condition without impacting the rhizomicrobiome. FEMS microbiology ecology, 94(7), fiy092. https://doi.org/10.1093/femsec/fiy092
Bagale, P., Pandey, S., Regmi, P., & Bhusal, S. (2022). Role of plant growth regulator “Gibberellins” in vegetable production: An overview. International journal of horticultural science and technology, 9(3), 291-299. https://doi.org/10.22059/ijhst.2021.329114.495
Bhatla, S. C., & Lal, M. A. (2023). Seed dormancy and germination. In Plant Physiology, Development and Metabolism (pp. 625-640). Singapore: Springer Nature Singapore. https://doi.org/10.1007/978-981-99-5736-1_28
Cano-González, M. Á., Ayil-Gutiérrez, B. A., Delgado-Martínez, R., Osorio-Hernández, E., Rangel-Lucio, J. A., & Poot-Poot, W. A. (2021). Physiological potential of piquin pepper seeds in response to pregermination treatments. Ciência e Agrotecnologia, 45, e019521. https://doi.org/10.1590/1413-7054202145019521
Cardarelli, M., Woo, S. L., Rouphael, Y., & Colla, G. (2022). Seed treatments with microorganisms can have a biostimulant effect by influencing germination and seedling growth of crops. Plants, 11(3), 259. https://doi.org/10.3390/plants11030259
Castro-Camba, R., Sánchez, C., Vidal, N., & Vielba, J. M. (2022). Plant development and crop yield: The role of gibberellins. Plants, 11(19), 2650. https://doi.org/10.3390/plants11192650
Costa, C. J., Meneghello, G. E., Jorge, M. H. A., & Costa, E. (2021). The importance of physiological quality of seeds for agriculture. Colloquium Agrariae, v. 17, n. 4, p. 102-119, ago. 2021. http://dx.doi.org/10.5747/ca.2021.v17.n4.a452
EL Sabagh, A., Islam, M. S., Hossain, A., Iqbal, M. A., Mubeen, M., Waleed, M., ... & Abdelhamid, M. T. (2022). Phytohormones as growth regulators during abiotic stress tolerance in plants. Frontiers in Agronomy, 4, 765068. https://doi.org/10.3389/fagro.2022.765068
El-Maarouf-Bouteau, H. (2022). The seed and the metabolism regulation. Biology, 11(2), 168. https://doi.org/10.3390/biology11020168
Farooq, M. A., Ma, W., Shen, S., & Gu, A. (2022). Underlying biochemical and molecular mechanisms for seed germination. International Journal of Molecular Sciences, 23(15), 8502. https://doi.org/10.3390/ijms23158502
Gough, R. E. (2020). Seed quality: basic mechanisms and agricultural implications. CRC Press.
Guzmán-Ortiz, F. A., Castro-Rosas, J., Gómez-Aldapa, C. A., Mora-Escobedo, R., Rojas-León, A., Rodríguez-Marín, M. L., ... & Román-Gutiérrez, A. D. (2019). Enzyme activity during germination of different cereals: A review. Food Reviews International, 35(3), 177-200. https://doi.org/10.1080/87559129.2018.1514623
Hassan, Z. M., Mana, H. A., & Abdullah, M. Q. (2021). Study of some physiological characteristics of pepper plant treated with gibberellin. International Journal of Agricultural & Statistical Sciences, 17. https://acortar.link/KQBn8s
ISTA Secretariat. (2024). Estándar de Acreditación ISTA para Análisis y Muestreo de Semillas. International Seed Testing Association. https://bit.ly/4fdPQph
Longo, C., Holness, S., De Angelis, V., Lepri, A., Occhigrossi, S., Ruta, V., & Vittorioso, P. (2020). From the outside to the inside: New insights on the main factors that guide seed dormancy and germination. Genes, 12(1), 52. https://doi.org/10.3390/genes12010052
Maguire, J. D. (1962). Speed of germination-aid in selection and evaluation for seedling emergence and vigor. Crop Science, 2(2), 176-177. https://doi.org/10.2135/cropsci1962.0011183X000200020033x
Martínez Solis, J., Virgen Vargas, J., Peña Ortega, M. G., & Santiago Romero, A. (2010). Índice de velocidad de emergencia en líneas de maíz. Revista mexicana de ciencias agrícolas, 1(3), 289-304. https://www.scielo.org.mx/pdf/remexca/v1n3/v1n3a2.pdf
Navarro, J. M., & Morte, A. (2024). Arbuscular mycorrhizal fungi as biofertilizers to increase the plant quality of Sour-Orange seedlings. Agronomy, 14(1), 230. https://doi.org/10.3390/agronomy14010230
Panda, D., & Mondal, S. (2020). Seed enhancement for sustainable agriculture: an overview of recent trends. Plant Arch, 20(1), 2320-2332.
Rafique, M., Naveed, M., Mustafa, A., Akhtar, S., Munawar, M., Kaukab, S., ... & Salem, M. Z. (2021). The combined effects of gibberellic acid and rhizobium on growth, yield and nutritional status in chickpea (Cicer arietinum L.). Agronomy, 11(1), 105. https://doi.org/10.3390/agronomy11010105
Ramos Cabrera, E. V., Delgado Espinosa, Z. Y., & Solis Pino, A. F. (2024). Use of Phosphorus-Solubilizing Microorganisms as a Biotechnological Alternative: A Review. Microorganisms, 12(8), 1591. https://doi.org/10.3390/microorganisms12081591
Samarah, N. H., Al-Quraan, N. A., Massad, R. S., & Welbaum, G. E. (2020). Treatment of bell pepper (Capsicum annuum L.) seeds with chitosan increases chitinase and glucanase activities and enhances emergence in a standard cold test. Scientia Horticulturae, 269, 109393. https://doi.org/10.1016/j.scienta.2020.109393
SANTOS, L. F., Lana, R. P., Silva, M., Veloso, T. G., Kasuya, M. C. M., & Ribeiro, K. G. (2020). Effective microorganisms inoculant: Diversity and effect on the germination of palisade grass seeds. Anais da Academia Brasileira de Ciências, 92, e20180426. https://doi.org/10.1590/0001-3765202020180426
Sawicka, B., Pszczółkowski, P., Barbaś, P., Skiba, D., & Bienia, B. (2022). The Role and Importance of Microorganisms in Environmental Sustainability. Microbial Biotechnology: Role in Ecological Sustainability and Research, 107-133. https://doi.org/10.1002/9781119834489.ch7
Sundareswaran, S., Ray Choudhury, P., Vanitha, C., & Yadava, D. K. (2023). Seed quality: Variety development to planting—An overview. Seed Science and Technology: Biology, Production, Quality, 1-16. https://doi.org/10.1007/978-981-19-5888-5
Taylor, A. G. (2020). Seed storage, germination, quality, and enhancements. In The physiology of vegetable crops (pp. 1-30). Wallingford UK: CABI. https://doi.org/10.1079/9781786393777.0001
Thakur, M., Tiwari, S., Kataria, S., & Anand, A. (2022). Recent advances in seed priming strategies for enhancing planting value of vegetable seeds. Scientia Horticulturae, 305, 111355. https://doi.org/10.1016/j.scienta.2022.111355
Tombegavani, S. S., Zahedi, B., Mousavi Fard, S., & Ahmadpour, A. (2020). Response of germination and seedling growth of pepper cultivars to seed priming by plant growth regulators. International Journal of Horticultural Science and Technology, 7(1), 59-68. https://doi.org/10.22059/ijhst.2020.274293.275
Vaishnav, D., & Chowdhury, P. (2023). Types and function of phytohormone and their role in stress. In Plant Abiotic Stress Responses and Tolerance Mechanisms. IntechOpen. https://doi.org/10.5772/intechopen.109325
Wang, G., Ren, Y., Bai, X., Su, Y., & Han, J. (2022). Contributions of beneficial microorganisms in soil remediation and quality improvement of medicinal plants. Plants, 11(23), 3200. https://doi.org/10.3390/plants11233200
Yang, Y., Gao, C., Ye, Q., Liu, C., Wan, H., Ruan, M., ... & Cheng, Y. (2024). The Influence of Different Factors on the Metabolism of Capsaicinoids in Pepper (Capsicum annuum L.). Plants, 13(20), 2887. https://doi.org/10.3390/plants13202887